由MAPT基因編碼的微管相關(guān)蛋白tau主要在神經(jīng)元中表達(dá)�����,tau蛋白在許多生理過程中發(fā)揮重要作用���。神經(jīng)細(xì)胞中tau蛋白的異常過度磷酸化和聚集是阿爾茨海默病�����、帕金森病和許多其他所謂的tauopathies的典型特征���,強(qiáng)調(diào)了理解�����、預(yù)防或逆轉(zhuǎn)這一過程的必要性��。通過靶向tau蛋白進(jìn)行治療干預(yù)�����,研究人員希望改善患者的預(yù)后���,并為目前無法治愈的神經(jīng)退行性疾病開發(fā)有效的治療方法。
為什么以tau單體為靶點(diǎn)?
正常情況下�,tau蛋白是單體的,在成人大腦中以6種不同的亞型(長度為352 - 441個氨基酸)表達(dá)1����。這些參與調(diào)節(jié)微管的組裝和穩(wěn)定性�,這是軸突生長和突觸囊泡運(yùn)輸?shù)年P(guān)鍵�。然而,在病理條件下����,過度磷酸化的tau單體從帶負(fù)電荷的微管中分離,首先聚集成寡聚體�,然后聚集成神經(jīng)原纖維纏結(jié)(NFTs),進(jìn)而導(dǎo)致神經(jīng)元變性2,3��。
盡管tau蛋白的病理機(jī)制尚未完全了解�����,但已經(jīng)提出了幾個假說�。一種建議是�����,天然Tau蛋白通過結(jié)構(gòu)轉(zhuǎn)變衍生出的具有種子活性的tau單體可能引發(fā)聚集�����,這表明了阻止這種轉(zhuǎn)化的治療潛力4���。另一種觀點(diǎn)認(rèn)為�,溶酶體應(yīng)激可能刺激種子活性單體tau蛋白釋放到細(xì)胞外空間,促使研究人員考慮抑制溶酶體胞外作用的治療用途5�����。我們也知道��,疾病相關(guān)的突變可以破壞tau蛋白內(nèi)具有聚集傾向的VQIVYK基序����,因此這可能被證明是一個有價值的治療靶點(diǎn)6。
tau單體如何用于聚集性分析?
已有各種模型用來研究tau蛋白聚集的過程�����,其中許多模型依賴于重組tau單體在體外復(fù)制聚集組裝����。一種流行的方法是使用聚集誘導(dǎo)劑,如聚陰離子(如肝素)�����、脂肪酸(如花生四烯酸)或tau原纖維絲從tau單體中形成聚集物��,使用熒光探針硫黃素S(結(jié)合豐富的β薄片結(jié)構(gòu))實(shí)時監(jiān)測聚集物的形成;例如��,這允許比較不同tau蛋白異構(gòu)體����、截斷的tau蛋白結(jié)構(gòu)域或蛋白質(zhì)突變體的聚集率3。其他類型的分析旨在研究在各種細(xì)胞系中過表達(dá)tau單體的影響�,同樣使用諸如硫黃素S等次級方法來跟蹤聚合產(chǎn)物。
用于聚合分析的高質(zhì)量tau單體
我們研發(fā)了一系列的試劑用于神經(jīng)退行性疾病Tau蛋白的研究����。其中包括在大腸桿菌(spr -327)或桿狀病毒(spr -473)中表達(dá)的人類活性重組Tau441 (2N4R)、P301S突變蛋白單體��、人類活性重組Tau441 (2N4R)野生型蛋白單體(spr -479)���、人類活性重組Tau (K18)�����、P301L突變蛋白單體(spr -328)以及人類活性重組Tau (K18) K280缺失蛋白單體(spr -476)。我們的活性人重組截取Tau片段 (AA297-391)蛋白單體dGAE (spr -444)和dGAE C322A (spr -445)�����,以及活性小鼠重組Tau441 (2N4R), P301S 突變蛋白單體 (spr -474)補(bǔ)充了這些蛋白��。其中許多已通過使用硫黃素T監(jiān)測聚集得到驗證���。
?
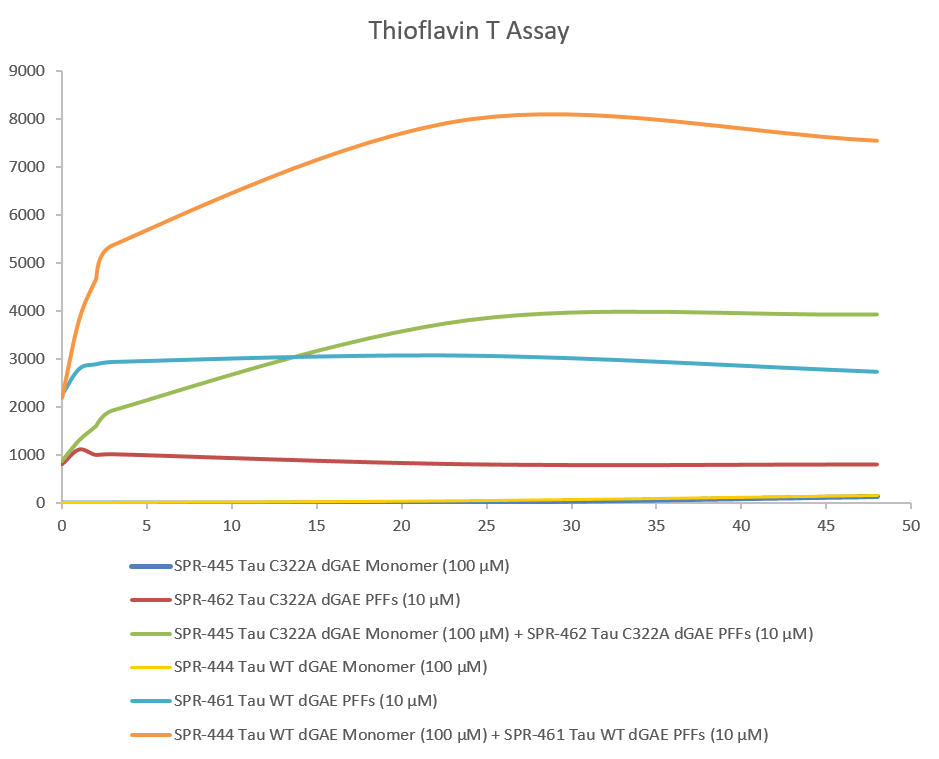
硫黃素T是一種熒光染料���,可與富含β薄片的結(jié)構(gòu)結(jié)合,如tau原纖維中的結(jié)構(gòu)����。結(jié)合后,染料的發(fā)射光譜發(fā)生紅移��,熒光強(qiáng)度增加�����。硫黃素T發(fā)射曲線顯示����,當(dāng)截斷tau片段(AA297-391) (dGAE C322A)單體與截斷tau片段(AA297-391) (dGAE C322A)預(yù)形成原纖維(Type 1)結(jié)合時����,熒光隨時間增加(與tau聚集相關(guān))����。
REFERENCES
1.?Tau-mediated Neurodegeneration and Potential Implications in Diagnosis and Treatment of Alzheimer’s Disease, Wu XL?et al, Chin Med J (Engl). 2017 Dec 20;130(24):2978-2990
2.?Phosphorylation and Dephosphorylation of Tau Protein During Synthetic Torpor, Luppi M?et al, Front. Neuroanat., 06 June 2019
3.?Cell-based Models To Investigate Tau Aggregation, Lim S?et al, Comput Struct Biotechnol J. 2014 Oct 2;12(20-21):7-13
4.?Inert and seed-competent tau- monomers suggest structural origins of aggregation, Mirbaha H?et al, Elife. 2018 Jul 10;7:e36584
5.?Seeding Activity-Based Detection Uncovers the Different Release Mechanisms of Seed-Competent Tau Versus Inert Tau via Lysosomal Exocytosis, Tanaka Y?et al, Front Neurosci. 2019 Nov 21;13:1258
6.?Tau local structure shields an amyloid-forming motif and controls aggregation propensity, Chen D?et al, Nat Commun. 2019 Jun 7;10(1):2493
?
更多常見問題及產(chǎn)品請咨詢Stressmarq一級代理商欣博盛生物
全國服務(wù)熱線: 4006-800-892? ? ? ?郵箱: market@neobioscience.com?
深圳: 0755-26755892? ? ? ? ?北京: 010-88594029? ? ? ? ?上海: 021-34613729? ? ? ? ? ?
廣州: 020-87615159? ? ? ? ? ?香港: 852-69410778?
代理品牌網(wǎng)站: m.smblzp.com?
自主品牌網(wǎng)站: www.neobioscience.net