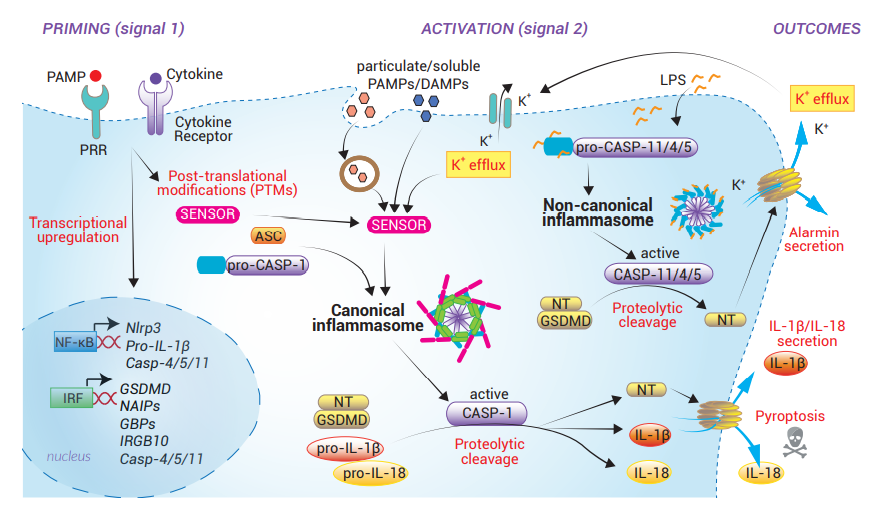
炎癥小體是由細(xì)胞內(nèi)的傳感器和連接著接頭蛋白的炎性caspase共同組成的多蛋白復(fù)合物�。它們的組裝可以由多種微生物和宿主源性刺激物觸發(fā)�����。一旦炎癥小體被激活��,它們就會(huì)在細(xì)胞表面形成Gasdermin-D膜孔���,允許非經(jīng)典分泌IL-1β和IL-18促炎細(xì)胞因子、IL-1α和HMGB1警報(bào)素蛋白�,最終導(dǎo)致細(xì)胞焦亡。當(dāng)炎癥小體的組裝需要caspase-1時(shí)�,它們屬于“經(jīng)典”的炎癥小體;當(dāng)炎癥小體的組裝依賴于人源caspase-4或caspase-5(或它們的小鼠同源蛋白caspase-11)時(shí)�,則為“非經(jīng)典”的炎癥小體。
炎癥小體傳感器
炎癥小體是根據(jù)其傳感器命名�����。這些傳感器主要是以蛋白質(zhì)結(jié)構(gòu)域分類的細(xì)胞質(zhì)模式識(shí)別受體(PRRs)。大多數(shù)PRRs都是屬于NLR(核苷酸結(jié)合域(NBD)和富含亮氨酸重復(fù)序列(LRR)受體)家族�����,特別是NLRP和NLRC亞群����。NLRPs與NLRCs的差異在于其N-末端的pyrin結(jié)構(gòu)域(PYD)和 caspase募集結(jié)構(gòu)域(CARD)。NLR傳感器包括NLRP3�、NLRP1和NLRC4能夠形成炎癥小體。其他非NLR傳感器也可以形成炎癥小體����,如AIM2和Pyrin。不論是否有ASC接頭蛋白���,這些傳感器可以通過(guò)招募caspase-1(CASP-1)引發(fā)經(jīng)典炎癥小體的組裝�。至于非經(jīng)典炎癥小體的組裝涉及同時(shí)具有傳感器和效應(yīng)蛋白功能的人源CASP-4/5或鼠源CASP-11�。
經(jīng)典炎癥小體傳感器
NLRP3(又名cryopyrin或NALP3)是自Tschopp團(tuán)隊(duì)在2004年發(fā)現(xiàn)其炎癥小體組裝功能以來(lái)最為廣泛研究的傳感器 [1]。這種LRR�NOD-PYD傳感器可被多種結(jié)構(gòu)和化學(xué)上不相關(guān)的刺激物激活(如造孔毒素�����、離子通道激活劑��、尿酸晶體、β-淀粉樣蛋白)[2-4]�,顯示出NLRP3不會(huì)直接與這些分子結(jié)合。NLRP3反而感測(cè)下游細(xì)胞應(yīng)激信號(hào)���,例如離子失衡���,尤其感測(cè)可能造成細(xì)胞內(nèi)穩(wěn)態(tài)絮亂的K+外排 [5]。重要的是����,NLRP3參與多種疾病的炎癥病理過(guò)程,包括阿爾茨海默病���、2型糖尿病和COVID-19(咨詢欣博盛生物獲取更詳細(xì)資料)�����。
NLRC4(又名Ipaf)是在2004年首次被Dixit團(tuán)隊(duì)報(bào)道其引發(fā)炎癥反應(yīng)的作用 [6]。后來(lái)����,Vance和Shao團(tuán)隊(duì)更證實(shí)NLRC4是一種間接傳感器,與NLR家族凋亡抑制蛋白(NAIPs)有相互作用�。NLRC4可以直接與細(xì)胞內(nèi)的細(xì)菌(如鞭毛蛋白)和細(xì)菌分泌系統(tǒng)的組成部分(如內(nèi)桿和針型蛋白)產(chǎn)生的PAMPs結(jié)合���。雖然人源NLRC4的上游只有一種NAIP蛋白去識(shí)別這些PAMPs的激活分子 [7],但研究顯示�,小鼠擁有多個(gè)NAIPs基因,不同的NAIPs蛋白在識(shí)別不同PAMPs分子有偏好性 [8-11]���。此外�����,NLRC4炎癥小體亦表現(xiàn)出可以保護(hù)肺部���、胃部和腸道中的粘膜屏障免受細(xì)菌入侵 [12]。
NLRP1(又名NALP1)是NLR家族第一個(gè)被發(fā)現(xiàn)的炎癥小體傳感器���,在2001-2002年被Tschopp團(tuán)隊(duì)描述了其特征 [13, 14]�。人源NLRP1具有一個(gè)CARD和一個(gè)PYD結(jié)構(gòu)域����;而鼠源NLRP1的旁系同源基因(a,b����,c)則欠缺了PYD結(jié)構(gòu)域�,這些同源基因當(dāng)中尤其以NLRP1b最為研究透徹���。另外���,人源和鼠源NLRP1都有一個(gè)位于CARD上游的獨(dú)特FIIND(function to find domain)結(jié)構(gòu)域。盡管目前仍然沒(méi)有辨別出NLRP1的同源配體 [15, 16]�����,但已知的是NLRP1b的活化由致病酶(例如炭疽桿菌致死因子或弗氏志賀菌IpaH7.8)所誘導(dǎo)���,這些致病酶會(huì)觸發(fā)FIIND結(jié)構(gòu)域的自切割和N末端結(jié)構(gòu)域的蛋白酶體降解 [16]�����。?
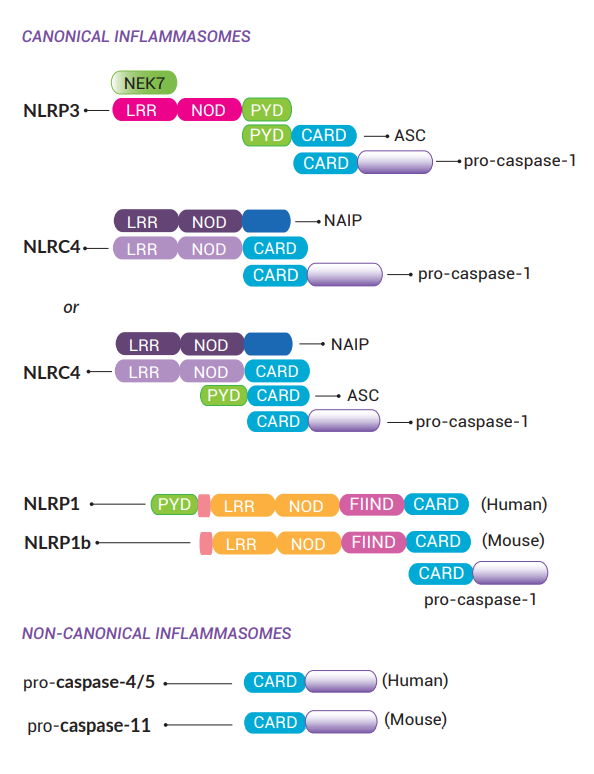
AIM2(黑色素缺乏因子2)是一種含有PYD結(jié)構(gòu)域和寡核苷酸結(jié)合結(jié)構(gòu)域的非NLR蛋白���。AIM2是微生物或宿主來(lái)源(細(xì)胞損傷后)的細(xì)胞質(zhì)雙鏈DNA(dsDNA)的受體,其識(shí)別不依賴特定的DNA序列順序���,但依賴于序列的長(zhǎng)度 [17-19]。雖然有研究證實(shí)AIM2在鼠源骨髓細(xì)胞中形成炎癥小體的功能�����,但在人源細(xì)胞的形成機(jī)制則尚未明確 [19-21]。
Pyrin最初是在攜帶MEFV基因突變的家族性地中海熱(FMF)患者中發(fā)現(xiàn)?���,F(xiàn)時(shí)除了知道它的激活涉及其PYD結(jié)構(gòu)域外,還未完全清楚它的激活機(jī)制�����。此外�����,盡管它已被證明能感應(yīng)細(xì)胞骨架動(dòng)態(tài)的異常變化����,并能被Rho修飾蛋白(例如艱難梭菌毒素B和肉毒梭菌毒素C3)激活 [15],但它的同源配體仍然不明��。
NLRP6 和 NLRP9b 傳感器越來(lái)越受到關(guān)注����,有數(shù)個(gè)研究顯示它們介導(dǎo)了小鼠的炎癥反應(yīng),尤其是在腸上皮細(xì)胞中的炎癥反應(yīng) [15]。
非經(jīng)典傳感器
人源caspase-4和caspase-5(CASP-4/5)和鼠源caspase-11(CASP-11)擁有雙重功能����。它們既是細(xì)胞溶質(zhì)脂多糖(LPS)直接的受體,也是炎癥小體直接的效應(yīng)蛋白�����。更確切地說(shuō)����,CASP-11/4/5形成非經(jīng)典炎癥小體,導(dǎo)致CASP-1依賴性的IL-1β和IL-18分泌��,以及CASP-1非依賴性的細(xì)胞死亡 [22, 23]�。
知識(shí)點(diǎn):“經(jīng)典”和“非經(jīng)典”的術(shù)語(yǔ)不僅指炎癥小體的類型,還指導(dǎo)致炎癥小體激活的途徑類型����。NLRP3和CASP-11分別形成經(jīng)典和非經(jīng)典炎癥小體。然而�����,NLRP3均可以通過(guò)經(jīng)典和非經(jīng)典途徑活化��,詳情請(qǐng)咨詢欣博盛生物,獲取更詳細(xì)的資料����。
接頭蛋白?
ASC(凋亡相關(guān)斑點(diǎn)樣蛋白)又名PYCARD���,是由CARD和PYD結(jié)構(gòu)域兩部分組成的接頭蛋白��,允許傳感器和pro-caspase-1之間的相互作用�����。這個(gè)蛋白是由不含CARD結(jié)構(gòu)域的炎癥小體傳感器(如NLRP3和AIM2)所招募的���。而NLRP1、NLRC4和CASP-11/4/5炎癥小體的形成過(guò)程并不需要ASC [15, 23]����。在靜止細(xì)胞中,ASC作為可溶蛋白分散存在于細(xì)胞質(zhì)和細(xì)胞核���。當(dāng)炎癥小體被激活后�����,ASC分子會(huì)在每個(gè)細(xì)胞中聚集形成一個(gè)微米級(jí)的“斑點(diǎn)”��,從而集中CASP-1的激活位點(diǎn) [24]����。
NEK7(NIMA相關(guān)蛋白激酶7)是一種與有絲分裂相關(guān)的絲氨酸�蘇氨酸激酶,最近被發(fā)現(xiàn)其為NLRP3炎癥小體活化的必需蛋白����,且作用于K+外排的下游。經(jīng)體內(nèi)和體外使用NLRP3激動(dòng)劑刺激驗(yàn)證���,NEK7的缺失會(huì)阻斷CASP-1的激活和IL-1β的釋放 [25]����。有研究顯示���,NEK7通過(guò)結(jié)合LRR結(jié)構(gòu)域���,橋接相鄰的NLRP3分子,從而發(fā)揮其支架功能 [26]�。?
效應(yīng)蛋白
Caspase-1(CASP-1)是一種半胱氨酸蛋白酶,最初被命名為白細(xì)胞介素-1β-轉(zhuǎn)換酶(ICE)[27]����。CASP-1由無(wú)活性的caspase-1前體(pro-caspase-1)生成����,包含N端CARD結(jié)構(gòu)域和兩個(gè)催化亞基p20和p10�。CASP-1通過(guò)其CARD結(jié)構(gòu)域被招募到經(jīng)典炎癥小體。有研究顯示�,四聚體形式的CASP-1(以及CASP-4或-11)允許鄰近誘導(dǎo)的自溶激活���,釋放p20和p10亞基 [28]�����?;罨腃ASP-1能夠?qū)ro-IL-1β和pro-IL-18細(xì)胞因子以及Gasdermin D切割為它們具生物活性的形態(tài)�����。目前還需要進(jìn)行更多的結(jié)構(gòu)研究去了解其確切的作用方式�。
Gasdermin D(GSDMD)又名DFNA5L或FKSG10,于2004年首次被發(fā)現(xiàn)�,但近10年來(lái)仍未清楚其生物學(xué)功能。這種細(xì)胞質(zhì)蛋白含有兩個(gè)被連接區(qū)域分隔的結(jié)構(gòu)域��,而C端結(jié)構(gòu)域(GSDMD-CT)會(huì)抑制著N端結(jié)構(gòu)域(GSDMD-NT)?��;罨腃ASP-1或CASP-11/4/5會(huì)切割它們中間的連接區(qū)域�,釋放GSDMD-NT片段�。GSDMD-NT其后與膜脂質(zhì)結(jié)合,導(dǎo)致其寡聚化并在細(xì)胞膜上形成內(nèi)徑約為18 nm的孔 [30]����。成熟的IL-1β、IL-18和警報(bào)素繼而通過(guò)GSDMD孔分泌出來(lái)���,最終GSDMD孔的積累會(huì)引致細(xì)胞焦亡���。
白細(xì)胞介素(IL)-1β和IL-18是在許多炎癥的激活和調(diào)節(jié)事件上起重要作用的細(xì)胞因子。IL-1β誘導(dǎo)包括發(fā)熱��、血管擴(kuò)張�����、遭受感染或組織損傷后的免疫細(xì)胞浸潤(rùn)等的基因表達(dá)控制�。IL-18除了是誘導(dǎo)干擾素-γ(IFN-γ)產(chǎn)生所必需的細(xì)胞因子外,也負(fù)責(zé)介導(dǎo)適應(yīng)性免疫應(yīng)答的共刺激性細(xì)胞因子�����。這兩種細(xì)胞因子必須通過(guò)切割其pro-IL-1β和pro-IL-18的酶原前體才能產(chǎn)成成熟的形態(tài) [31]。由于它們?nèi)狈M(jìn)入囊泡介導(dǎo)的生物合成途徑所必需的N端信號(hào)序列���,這些細(xì)胞因子會(huì)從非經(jīng)典途徑(即通過(guò)GSDMD孔)分泌����。
警報(bào)素(Alarmins)是受損或死亡的細(xì)胞對(duì)感染或損傷作出反應(yīng)時(shí)所釋放的DAMPs��。這些分子在體內(nèi)穩(wěn)態(tài)時(shí)以低水平存在于細(xì)胞質(zhì)中���,并隨時(shí)準(zhǔn)備在炎癥小體應(yīng)答時(shí)分泌。當(dāng)它們的表達(dá)被上調(diào)��,危險(xiǎn)信號(hào)得以傳播出去�。其中IL-1α [32]和HMGB1(高遷移率族蛋白-1)[33]被認(rèn)為是炎癥小體激活時(shí)釋放的兩種主要警報(bào)素蛋白。
更多技術(shù)資料或相關(guān)產(chǎn)品詳情請(qǐng)咨詢Invivogen中國(guó)一級(jí)代理商-欣博盛生物
參考資料?
1. Agostini, L., et al., Immunity, 2004. 20(3): p. 319-325.
2. Mariathasan, S., et al., Nature, 2006. 440(7081): p. 228-232.
3. Martinon, F., et al., Nature, 2006. 440(7081): p. 237-241.
4. Kanneganti, T.-D., et al., Nature, 2006. 440(7081): p. 233-236.
5. Swanson, K.V., M. Deng, and J.P.Y. Ting, Nature Reviews Immunology, 2019.
6. Mariathasan, S., et al., Nature, 2004. 430(6996): p. 213-218.
7. Yang, J., et al., Proceedings of the National Academy of Sciences, 2013. 110(35): p. 14408-14413.
8. Kofoed, E.M. and R.E. Vance, Nature, 2011. 477(7366): p. 592-595.
9. Zhao, Y., et al., Nature, 2011. 477(7366): p. 596-600.
10. Rauch, I., et al., Journal of Experimental Medicine, 2016. 213(5): p. 657-665.
11. Zhao, Y., et al., Journal of Experimental Medicine, 2016. 213(5): p. 647-656.
12. Bauer, R. and I. Rauch, Molecular Aspects of Medicine, 2020(76): p. 100863.
13. Martinon, F., K. Hofmann, and J. Tschopp, Current Biology, 2001. 11(4): p. R118-R120.
14. Martinon, F., K. Burns, and J. Tschopp, Molecular Cell, 2002. 10(2): p. 417-426.
15. Xue, Y., et al., Trends in Immunology, 2019. 40(11): p. 1035-1052.
16. Taabazuing, C.Y., A.R. Griswold, and D.A. Bachovchin, Immunological Reviews, 2020. 297(1): p. 13-25.
17. Hornung, V., et al., Nature, 2009. 458: p. 514.
18. Fernandes-Alnemri, T., et al., Nature, 2009. 458(7237): p. 509-513.
19. Hayward, J.A., et al., Microbiology and Molecular Biology Reviews, 2018. 82(4): p. e00015-18.
20. Jones, J.W., et al., Proceedings of the National Academy of Sciences, 2010. 107(21): p. 9771-9776.
21. Gaidt, M.M., et al., Cell, 2017. 171(5): p. 1110-1124.e18.
22. Kayagaki, N., et al., Nature, 2011. 479(7371): p. 117-121.
23. Shi, J., et al., Nature, 2014. 514: p. 187.
24. Hoss, F., J.F. Rodriguez-Alcazar, and E. Latz, Cellular and Molecular Life Sciences, 2017. 74(7): p. 1211-1229.
25. He, Y., et al., Nature, 2016. 530: p. 354.
26. Sharif, H., et al., Nature, 2019. 570(7761): p. 338-343.
27. Thornberry, N.A., et al., Nature, 1992. 356(6372): p. 768-774.
28. Shi, J., et al., Nature, 2015. 526: p. 660.
29. Man, S.M. and T.-D. Kanneganti, Nature Reviews Immunology, 2015. 16(1): p. 7-21.
30. Ding, J., et al., Nature, 2016. 535(7610): p. 111-116.
31. Dinarello, C.A., Immunological Reviews, 2018. 281(1): p. 8-27.
32. Di Paolo, N.C. and D.M. Shayakhmetov, Nature Immunology, 2016. 17(8): p. 906-913.
33. Kang, R., et al., Molecular Aspects of Medicine, 2014. 40: p. 1-116.