炎癥小體依賴于一個(gè)“兩步”活化模型��。不過每個(gè)炎癥小體都有獨(dú)特的傳感器激活和平臺(tái)關(guān)聯(lián)機(jī)制�。這些傳感器既可以直接與它的激動(dòng)劑結(jié)合,也可以依賴于另一種分子�����。ASC接頭蛋白對(duì)于某些炎癥小體的組裝是必需的�,但也可以不參與或完全缺乏于某些炎癥小體的組裝。不同炎癥小體之間的相互作用通過特定的保守結(jié)構(gòu)域發(fā)生���。各種激活和組裝策略可能經(jīng)進(jìn)化��,演變成能對(duì)威脅做出及時(shí)的響應(yīng)���。
“兩步”激活模型
啟動(dòng)(Priming)和激活是所有炎癥小體都需要的兩個(gè)步驟。首先����,啟動(dòng)步驟可以視為一種必要的調(diào)節(jié)�,以避免不必要的激活��。它允許炎癥小體組裝和下游信號(hào)所需蛋白的轉(zhuǎn)錄上調(diào)�。一旦啟動(dòng),傳感器將保持在自動(dòng)抑制但對(duì)信號(hào)敏感的狀態(tài)���。它們通過直接的配體結(jié)合或間接的細(xì)胞內(nèi)事件被不同的PAMPs或DAMPs激活。
第二步激活��,是誘導(dǎo)啟動(dòng)后的傳感器進(jìn)行翻譯后修飾(PTMs)�,導(dǎo)致去抑制的構(gòu)象變化。這是傳感器寡聚化和炎癥小體平臺(tái)組裝的起點(diǎn)�����。下文我們?cè)敿?xì)介紹了NLRP3�����、NLRC4和CASP-11/4/5炎癥小體的獨(dú)特激活和組裝機(jī)制�����。
NLRP3炎癥小體
NLRP3炎癥小體是最被研究透徹的經(jīng)典炎癥小體。然而�����,關(guān)于NLRP3激活的確切機(jī)制仍存在爭(zhēng)議 [5, 38]�����。NLRP3可以被一系列結(jié)構(gòu)上和化學(xué)上無關(guān)的刺激物激活��。這些刺激物可以是無菌的(例如尿酸晶體��、β-淀粉樣蛋白���、膽固醇晶體)��、來自微生物(例如造孔毒素����、離子通道激活劑)或環(huán)境的(例如石棉�、二氧化硅)[5]。目前的認(rèn)知是NLRP3不直接與這些分子結(jié)合�。相反,它感知下游細(xì)胞溶質(zhì)應(yīng)激信號(hào)����,如K+ 外排 [5, 38]�、外化線粒體心磷脂和氧化線粒體DNA���,后兩者在一些研究中被認(rèn)為是NLRP3的“最終”配體 [39-41]����。
NLRP3是一種擁有三個(gè)結(jié)構(gòu)域的蛋白�����,包含LRR����、NOD(或NATCH)和PYD結(jié)構(gòu)域(見第4頁)�。由于NOD和LRR結(jié)構(gòu)域之間的內(nèi)部相互作用,NLRP3被自動(dòng)抑制為閉合構(gòu)象 [42]�。NOD結(jié)構(gòu)域的ATP結(jié)合和水解允許NLRP3變成開放構(gòu)象 [43]。此外��,PTMs由不同的刺激物驅(qū)動(dòng)����,這些刺激物可以靶向NLRP3結(jié)構(gòu)域中的特定殘基 [38, 44, 45]����。例如PRR配體(如LPS或Pam3CSK4)的刺激�����,可以在NOD結(jié)構(gòu)域中導(dǎo)致JNK1介導(dǎo)的S198磷酸化以及NLRP3去泛素化 [44]�����。一旦LRR結(jié)構(gòu)域被暴露���,它就與NEK7(NimA相關(guān)蛋白激酶7)結(jié)合����。NEK7對(duì)于橋接相鄰NLRP3亞單位之間的間隙是必需的���,不過�����,這種相互作用發(fā)生的時(shí)間和位置尚未完全闡明 [25-27]��。NLRP3的激活會(huì)使炎癥小體開始組裝���。NLRP3-PYD結(jié)構(gòu)域招募ASC�,然后通過其CARD結(jié)構(gòu)域與pro-caspase-1結(jié)合���。CASP-1受鄰近誘導(dǎo)進(jìn)行自溶性活化��,從而使細(xì)胞表面形成GSDMD孔�,允許IL-1β/IL-18和警報(bào)素分泌�����,最終導(dǎo)致細(xì)胞焦亡 [5, 46]�。
細(xì)胞器在NLRP3炎癥小體組裝中起關(guān)鍵作用 [5, 47]。啟動(dòng)和激活信號(hào)一同協(xié)調(diào)NLRP3炎癥小體成分在線粒體����、內(nèi)質(zhì)網(wǎng)(ER)和高爾基體的亞細(xì)胞定位����。至于是否存在多種細(xì)胞器的機(jī)制去調(diào)控NLRP3炎癥小體組裝則還在研究中 [48]。
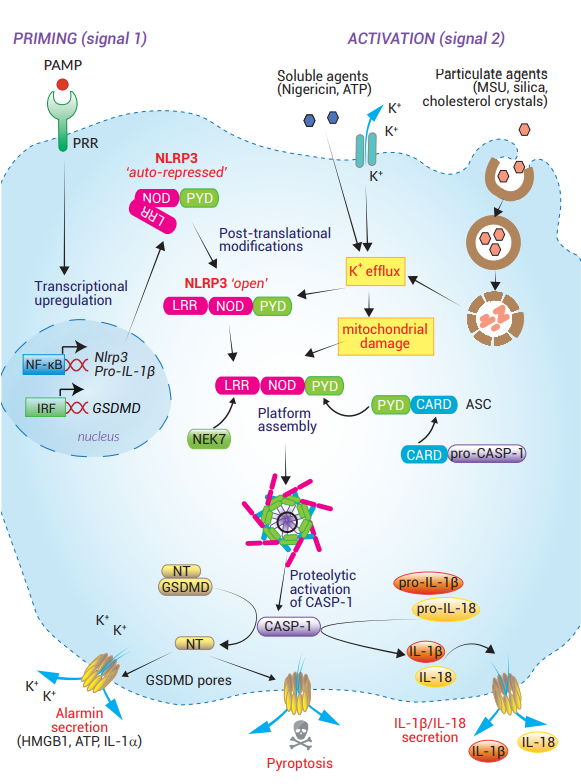
NLRP3炎癥小體已被發(fā)現(xiàn)有不同的啟動(dòng)機(jī)制���。長時(shí)間的TLR刺激(>3小時(shí))可以觸發(fā)NF-κB介導(dǎo)的新NLRP3分子轉(zhuǎn)錄 [44, 49]���。短時(shí)間的TLR刺激(<1小時(shí))較可能觸發(fā)MyD88或TRIF介導(dǎo)的NLRP3蛋白PTM [44, 50]��。PTM介導(dǎo)的NLRP3啟動(dòng)可能已經(jīng)進(jìn)化到允許即時(shí)的炎癥反應(yīng)發(fā)生���。另外,轉(zhuǎn)錄介導(dǎo)的啟動(dòng)可以通過上調(diào)NLRP3和效應(yīng)分子的表達(dá)�,來增強(qiáng)炎癥反應(yīng)。近期也有研究顯示�,至少在體外的人類單核細(xì)胞中,TLR介導(dǎo)的啟動(dòng)對(duì)于NLRP3炎癥小體的活化并不是必需的 [51]�。
重要的是,非經(jīng)典炎癥小體CASP-11/4/5炎癥反應(yīng)也能觸發(fā)NLRP3炎癥小體的激活和組裝(見下文)����。
NLRC4/NAIP炎癥小體
NLRC4感測(cè)細(xì)胞內(nèi)細(xì)菌分子,如屬于運(yùn)動(dòng)器官的鞭毛蛋白��,或來自細(xì)菌III型或IV型分泌系統(tǒng)(T3SS或T4SS)的內(nèi)桿和針狀蛋白�。更具體地說,NAIP與其相應(yīng)的配體直接結(jié)合后���,再結(jié)合NLRC4�����。另外���,人源和鼠源的NAIP表達(dá)存在差異��。人源基因組只表達(dá)一種NAIP���,作用于NLRC4上游并與上述激活劑結(jié)合 [7, 52]。這種獨(dú)特的人源NAIP存在兩種異構(gòu)體���,且對(duì)感知鞭毛蛋白和T3SS蛋白有不同的親和力 [52]���。而小鼠表達(dá)多個(gè)NAIPs,它們對(duì)每個(gè)配體都表現(xiàn)出不同的親和力��;例如NAIP1對(duì)T3SS針狀蛋白具有較高的親和力��,NAIP2對(duì)T3SS內(nèi)桿蛋白具有較高的親和力�,NAIP5和NAIP6對(duì)鞭毛蛋白具有較高的親和力 [8-11]���。盡管NAIPs和NLRC4的轉(zhuǎn)錄調(diào)控仍缺乏文獻(xiàn)記載�����,但最近發(fā)現(xiàn)鼠源NAIPs的本底表達(dá)至少依賴于IRF8 [53] ���。
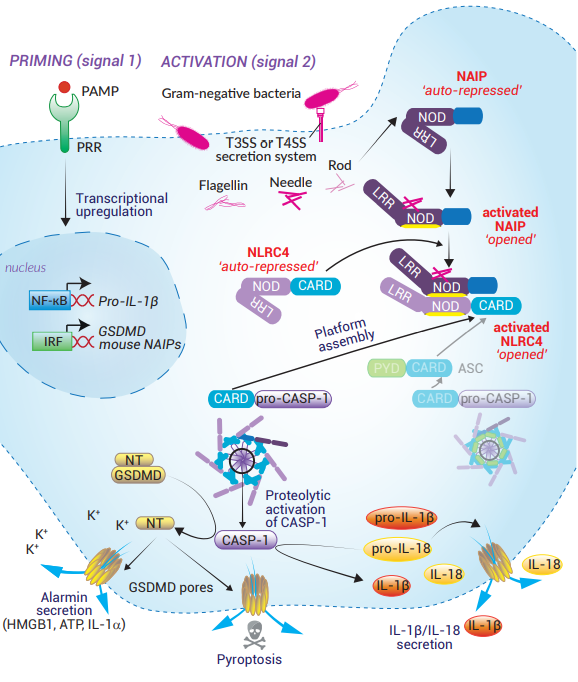
NAIPs和NLRC4擁有相似的LRR和NOD結(jié)構(gòu)域���,其中LRR結(jié)構(gòu)域是令它們處于自抑制狀態(tài)所必需的 [8, 54-56]。此外��,NLRC4還有一個(gè)CARD 結(jié)構(gòu)域����。一旦配體結(jié)合到NAIP的NOD區(qū)域,處于自抑制狀態(tài)的NAIP就會(huì)伸展出來��,暴露出NOD結(jié)構(gòu)域 [55]����。被激活的NAIP通過NOD-NOD相互作用募集NLRC4啟動(dòng)子(promoter),迫使NLRC4開放�。而活化的NLRC4利用其暴露出來的NOD表面與其他NLRC4分子發(fā)生骨牌反應(yīng),形成組裝炎癥小體平臺(tái) [56]�����。NLRC4的CARD結(jié)構(gòu)域聚集后會(huì)使NLRC4聚合化,NLRC4/NAIP復(fù)合物然后可以通過直接的CARD-CARD相互作用或通過ASC接頭蛋白與pro-caspase-1結(jié)合 [15, 56]���。
CASP-11和CASP-4/5非經(jīng)典炎癥小體
鼠源CASP-11和人源CASP-4/5同時(shí)作為傳感器和效應(yīng)蛋白分子���,形成非經(jīng)典炎癥小體。CASP-11是在感染革蘭氏陰性細(xì)菌小鼠模型中首次被發(fā)現(xiàn)能感應(yīng)細(xì)胞內(nèi)的LPS����,且不依賴于細(xì)胞表面的LPS受體TLR4 [57, 58]。此外�����,CASP-11和CASP-4/5會(huì)驅(qū)動(dòng)GSDMD介導(dǎo)的細(xì)胞死亡和CASP-1依賴性的IL-1β/IL-18分泌 [22]���。
LPS的識(shí)別和caspase的寡聚化都是被CASP-11/4/5的CARD結(jié)構(gòu)域所介導(dǎo)�����,它們也是使其自身亞單位進(jìn)行自催化激活所必需的 [29]����。這些活化的caspase會(huì)切割GSDMD�����,最終誘導(dǎo)細(xì)胞焦亡的發(fā)生����。與CASP-1不同,CASP-11/4/5不會(huì)將pro-IL-1β和pro-IL-18切割成成熟形態(tài) [59]�。當(dāng)質(zhì)膜形成GSDMD孔,會(huì)釋放出作為應(yīng)激信號(hào)的胞漿成分����。K+外排會(huì)促使NLRP3炎癥小體組裝和CASP-1介導(dǎo)的IL-1β/IL-18分泌 [38, 60]。不過���,關(guān)于CASP-11/4/5確切的激活機(jī)制仍需要進(jìn)行深入的研究��。
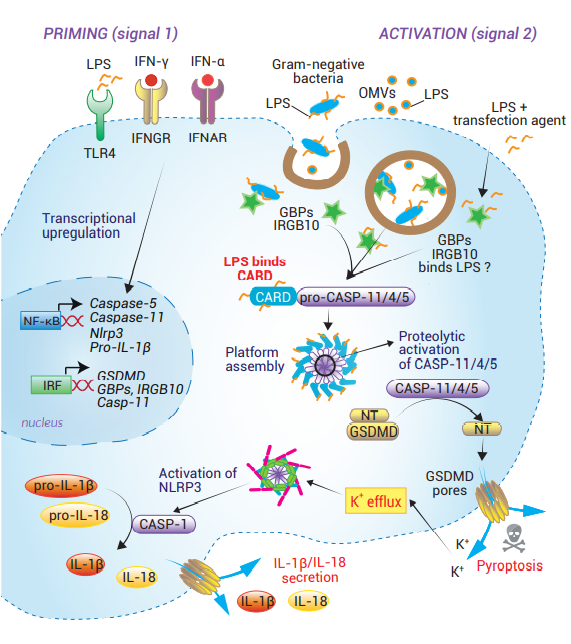
細(xì)胞外LPS通過細(xì)菌OMV的攝?��。ㄒ姷?3頁)或細(xì)胞內(nèi)細(xì)菌的溶解進(jìn)入胞質(zhì) [57, 61]。之后的事件會(huì)涉及鳥苷酸結(jié)合蛋白(GBPs)和干擾素反應(yīng)基因B10蛋白(IRGB10)的參與��。GBPs積聚在吞噬體膜上����,促使細(xì)菌產(chǎn)物(如DNA�����、LPS)釋放到細(xì)胞質(zhì)中 [62]���。它們會(huì)通過招募IRGB10參與穿透細(xì)胞內(nèi)細(xì)菌膜 [63]。GBPs也被認(rèn)為能促使CASP-11與LPS疏水脂質(zhì)A的相互作用 [64]��。
人源CASP-4/5和鼠源CASP-11的本底表達(dá)會(huì)因細(xì)胞類型而有所不同�,它們的表達(dá)可在使用各種TLR激動(dòng)劑(如LPS和Pam3CSK4)和干擾素(IFN-β和IFN-γ)預(yù)處理后獲得上調(diào) [22, 65-67]。同樣�,GBPs和IRGB10也受干擾素轉(zhuǎn)錄調(diào)控 [67]。
既然人類基因存在著兩種CASP-11相似的蛋白����,這就引申出CASP-4和CASP-5在功能上是否具冗余性的問題。目前有體外實(shí)驗(yàn)顯示要應(yīng)答轉(zhuǎn)染的LPS��,最低限度也需要CASP-5��,但在小鼠感染傷寒沙門氏菌的情況下CASP-5則是必需的 [68]����。CASP-4和CASP-5在體內(nèi)細(xì)菌感染中的確切作用還待進(jìn)一步研究。
更多資料或相關(guān)產(chǎn)品信息請(qǐng)咨詢Invivogen中國一級(jí)代理商-欣博盛生物
參考資料:
5. Swanson, K.V., M. Deng, and J.P.Y. Ting, Nature Reviews Immunology, 2019
7. Yang, J., et al., Proceedings of the National Academy of Sciences, 2013. 110(35): p. 14408-14413.
8. Kofoed, E.M. and R.E. Vance, Nature, 2011. 477(7366): p. 592-595.
9. Zhao, Y., et al., Nature, 2011. 477(7366): p. 596-600.
10. Rauch, I., et al., Journal of Experimental Medicine, 2016. 213(5): p. 657-665.
11. Zhao, Y., et al., Journal of Experimental Medicine, 2016. 213(5): p. 647-656.
15. Xue, Y., et al., Trends in Immunology, 2019. 40(11): p. 1035-1052
22. Kayagaki, N., et al., Nature, 2011. 479(7371): p. 117-121.
25. He, Y., et al., Nature, 2016. 530: p. 354
26. Sharif, H., et al., Nature, 2019. 570(7761): p. 338-343.
27. Thornberry, N.A., et al., Nature, 1992. 356(6372): p. 768-774.
29. Man, S.M. and T.-D. Kanneganti, Nature Reviews Immunology, 2015. 16(1): p. 7-21.
38. Yang, Y., et al., Cell Death & Disease, 2019. 10(2): p. 128.
39. Iyer, S.S., et al., Immunity, 2013. 39(2): p. 311-323.
40. Elliott, E.I., et al., The Journal of Immunology, 2018. 200(9): p. 3047-3052.
41. Zhong, Z., et al., Nature, 2018. 560(7717): p. 198-203.
42. Tschopp, J. and K. Schroder, Nature Reviews Immunology, 2010. 10(3): p. 210-215.
43. Duncan, J.A., et al., Proceedings of the National Academy of Sciences, 2007. 104(19): p. 8041-8046.
44. Groslambert, M. and B.F. Py, J Inflamm Res, 2018. 11: p. 359-374.
45. Kelley, N., et al., International Journal of Molecular Sciences, 2019. 20(13): p. 3328.
46. Platnich, J. and D. Muruve, Archives of Biochemistry and Biophysics, 2019. 670.
47. Hamilton, C. and P. Anand, . F1000Research, 2019. 8(676).
48. Chen, J. and Z.J. Chen, Nature, 2018. 564(7734): p. 71-76.
49. Bauernfeind, F.G., et al., The Journal of Immunology, 2009. 183(2): p. 787-791.
50. Lin, K.-M., et al., Proceedings of the National Academy of Sciences, 2014. 111(2): p. 775-780.
52. Kortmann, J., S.W. Brubaker, and D.M. Monack, The Journal of Immunology, 2015. 195(3): p. 815-819
54. Hu, Z., et al., Science, 2013. 341(6142): p. 172-175.
55. Tenthorey, Jeannette L., et al., Molecular Cell, 2014. 54(1): p. 17-29.
56. Zhang, L., et al., Science, 2015. 350(6259): p. 404-409.
57. Kayagaki, N., et al., Science, 2013. 341(6151): p. 1246-1249.
58. Hagar, J.A., et al., Science, 2013. 341(6151): p. 1250-1253.
60. Broz, P. and V.M. Dixit, Nature Reviews Immunology, 2016. 16: p. 407.
61. Kaparakis-Liaskos, M. and R.L. Ferrero, Nature Reviews Immunology, 2015. 15: p. 375.
62. Meunier, E., et al., Nature, 2014. 509(7500): p. 366-370.
63. Man, S.M., et al., Cell, 2016. 167(2): p. 382-396.e17.
64. Santos, J.C., et al., The EMBO journal, 2018. 37(6): p. e98089.
65. Bian, Z.-M., et al., Investigative Ophthalmology & Visual Science, 2011. 52(12): p. 8646-8656.
66. Rathinam, Vijay A.K., et al., Cell, 2012. 150(3): p. 606-619.
67. Christgen, S., D.E. Place, and T.-D. Kanneganti, Cell Research, 2020.
68. Baker, P.J., et al., European Journal of Immunology, 2015. 45(10): p. 2918-2926